Переклад статі "Psychiatric face of COVID-19" Автори Luca Steardo Jr., Luca Steardo & Alexei Verkhratsky
У рамках програми розповсюдження інформації пов'язаної з боротьбою з коронавірусною хворобою COVID-19 та її наслідками:
UNIVERSUM.CLINIC публікує переклади українською мовою набільш грунтовних, актуальних та цікавих (на наш погляд) медичних матеріалів.
Для інформаційної залученості медичної спільноти України до сучасних світових тенденцій та підвищення рівня медичної освіти суспільства загалом.
Посилання на оригінал: https://www.nature.com/articles/s41398-020-00949-5.pdf
Переклад українською: Наталія Зохнюк / UNIVERSUM.CLINIC
Зміст
Анотація
Вступ: інфекційні пандемії як фактор ризику для психічних захворювань
Нейротропізм коронавірусів
Нейрозапалення при COVID-19
COVID-19 та великий депресивний розлад
COVID-19 та біполярний розлад (БР)
COVID-19 та реактивний психоз
COVID-19 та обсесивно-компульсивний розлад
COVID-19 та епілепсія
COVID-19 та посттравматичний стресовий розлад
Шизофренія та вірусна інфекція
Висновки
Notes
References
Анотація
Коронавірусна хвороба 2019 (COVID-19) являє собою важку поліорганну патологію, яка, крім серцево-респіраторних проявів, впливає на функцію центральної нервової системи (ЦНС). Тяжкий гострий респіраторний синдром коронавірусу 2 (SARS-CoV-2), як і інші коронавіруси, демонструє нейротропізм; вірусна інфекція стовбура мозку може ускладнити перебіг захворювання через пошкодження центрального серцево-дихального контролю. Системне запалення, а також нейрозапальні зміни пов’язані з масовим збільшенням прозапальних молекул мозку, нейрогліальною реактивністю, зміненим нейрохімічним ландшафтом та патологічним перебудовою нейрональних мереж. Ці органічні зміни, що виникають спільно із стресом навколишнього середовища, спричиненим переживаннями перебування в палатах інтенсивної терапії, страхом пандемії та соціальними обмеженнями, сприяють розвитку нервово-психічних патологій, включаючи великий депресивний розлад, біполярний розлад (БР), різні психози, обсесивно-компульсивний розлад та посттравматичний стресовий розлад. Нейропсихіатричні наслідки COVID-19 представляють серйозну клінічну проблему, яку слід враховувати при майбутніх складних терапіях.
Вступ: інфекційні пандемії як фактор ризику для психічних захворювань
Людська цивілізація завжди співіснувала з паразитарними формами, представленими бактеріями та вірусами, які незмінно забирали життя. Коли соціальні, біологічні та економічні фактори збігались, інфекції набули широкого поширення, досягнувши рівня пандемії, що спричинило масові смерті та нещастя. Пандемії похитнули основи суспільства і змінили хід історії та мислення людства. Тифозна лихоманка спустошила Афіни в 490 р. до н.е., тим самим давши перевагу військовому суспільству Спарти в Пелопоннеській війні, чума Юстиніана прирекла реінкарнацію Римської імперії, тоді як Чорна смерть, спричинена Yersinia pestis, яка вбила третину населення Європи, спонукала до тектонічних змін в економічних відносинах, які в кінцевому підсумку позбулися кріпосного права і феодалізму та заклали основи Відродження.
Остання глобальна епідемія іспанського грипу, яка спричинила 20–50 мільйонів смертей, збіглася з Першою світовою війною, міжусобними конфліктами та народженням більшовизму, що разом призвело до великого сум'яття в людстві. Рухи великих мас солдатів із США принесли вірус грипу A H1N1 до Європи, порушення роботи медичних служб, погана гігієна, руйнування війни та недоїдання - все це спричинило суперінфекцію надзвичайно високою смертністю.
Усі основні пандемії, пов'язані із сильним стресом навколишнього середовища, впливають на спосіб мислення людини та психологічне здоров'я. Систематичні дослідження, спрямовані на виявлення патогенетичних механізмів, відповідальних за виникнення психічних захворювань після вірусних епідемій, розпочаті в 19 столітті. Видатний англійський лікар Генрі Холланд у 1839 р. проголосив, що грип відповідає за «Із виявлених порушень психічних функцій майже в однаковому співвідношенні тіла ....... і що поведінкові зміни не були порівнянні з тими, що є вторинними щодо інших лихоманок ". Через вісімдесят років Карл Меннігер підтвердив зв’язок між вірусними інфекціями та психічною захворюваністю: «Сто випадків психічних захворювань, пов’язаних з грипом в останній пандемії, були вивчені в Бостонській психопатичній лікарні. Різноманітність виявлених психічних розладів широка ... їх легко класифікувати на чотири групи: марення, деменція, інші психози та некласифіковані. Серед них чисельність найбільшою групою є деменція praecox ”.
З роками накопичені клінічні дані мають зміцнили наші знання про психіатричні особливості церебральних захворювань. За останні кілька десятиліть інтерес до передбачуваної етіологічної ролі вірусів поступово посилювався, охоплюючи не лише органічні психічні розлади, спричинені гострим вірусним енцефалітом та повільними вірусними інфекціями центральної нервової системи (ЦНС), але також охоплював так званими функціональними психіатричними захворюваннями, такими як психози, депресія та біполярний розлад (БР). Загальновизнано, що поєднання системної інфекції, вірусного нейротропізму та стресу з навколишнього середовища полегшують або навіть стимулюють розвиток психічних патологій, які посилюють перебіг пандемії і представляють значну терапевтичну проблему.
Нейротропізм коронавірусів
Пандемія хвороби коронавірусу 2019 (COVID-19) відроджує давно забутий виклик для людства, яке жило в (ілюзійному) середовищі масового зараження. Боротьба з невизначеністю нещодавно виниклої хвороби, проти якої не існує ні вакцини, ні ефективного протоколу лікування, людство, швидше за все, буде існувати в новій реальності місяцями, якщо не роками до впровадження глобального засобу захисту. Яким чином вірус взаємодіє з нашим організмом та якими є патофізіологічні сценарії розвитку гострої фази хвороби та довготривалі наслідки - це найважливіші питання для вирішення медичних стратегій.
COVID-19 є результатом зараження новим коронавірусом, який вперше був виявлений у Китаї після первинного спалаху в 2019 році. Цей коронавірус, названий важким гострим респіраторним синдромом коронавірусу 2 (SARSCoV-2), належить до групи 2B сімейства β-коронавірусу . SARS-CoV-2 визнаний сьомим компонентом родини коронавірусів і був включений до підродини ортокоронавірини. Коронавіруси - це одноланцюгові РНК-віруси, як правило, пов’язані з респіраторними захворюваннями; вони також (хоча і рідше) можуть викликати шлунково-кишкові та неврологічні розлади у широкого кола ссавців та птахів. Коронавіруси мають високі показники мутації та рекомбінації, а також схильність до перехресної передачі. SARS-CoV-2 потрапляє в клітину після зв’язування з ферментом АСЕ2 з подальшою ендоцитарною інтерналізацією. Основними мішенями для вірусу є епітеліальні клітини легенів та шлунково-кишкового тракту.
Ендоцитоз вірусного комплексу ACE2 також призводить до виснаження пулу ACE2 з подальшим зменшенням інверсії ангіотензину II до ангіотензину; останній пептид володіє вираженими протизапальними властивостями, а зниження Arg 1–7 суттєво сприяє легеневій недостатності та масовому виникненню легеневого фіброзу, описаного у пацієнтів з COVID-19. Чи може SARS-CoV-2 проникати в клітини через альтернативні шляхи залишаються незрозумілими, хоча на відміну від інших коронавірусів, SARS-CoV-2 не зв'язується з рецепторами, такими як амінопептидаза N та дипептидилпептидаза.
У клінічній презентації COVID-19 переважають респіраторні ознаки з рідшою появою шлунково-кишкових симптомів. Інвазія вірусу не обмежується цими двома органами, особливо враховуючи, що значна експресія АПФ2 виявляється в інших тканинах, включаючи серце, нирки, ендотелій та ЦНС. Вірусна інфекція мозку може мати численні неврологічні та психіатричні наслідки, сприяючи як гострій фазі захворювання, так і його потенційним наслідкам. Нейротропізм добре задокументований для декількох β-коронавірусів, включаючи SARS-CoV-1, MERS-CoV та вірус HEV 67 N свинячого гемаглютинаційного енцефаломієліту. Можливо, основний шлях для SARSCoV-2 пов’язаний з АСЕ2, експресованим у нейронах та нейроглії. Нейронні клітини, що експресують АСЕ2, знаходяться у навколо вентрикулярних органах, таких як субфонікалький орган, паравентрикулярне ядро, одиночний тракт та ростральний вентролатеральний довгастий мозок. Усі ці регіони мало захищені гематоенцефалічним бар’єром (ГЕБ) і всі вони беруть участь у серцево-судинній та дихальній регуляції. Відсутність ГЕБ робить ці ділянки ЦНС уразливими при багатьох патологіях, таких як різні типи системного запалення, включаючи енцефалопатію, пов’язану з сепсисом, нейроінфекцію бактеріями, вірусами або паразитами, стрес та аутоімунний енцефаліт. Мікрогліальні клітини, локалізовані в навколовентрикулярниз органах, здається, перебувають у стані хронічної активації, намагаючись обмежити надходження в паренхіму циркулюючих нейротоксичних молекул або інвазивних агентів та зберегти мозковий гомеостаз. SARS-CoV-2, подібно до інших респіраторних вірусів, може отримати доступ до ЦНС кількома шляхами, наприклад, мігруючи через аксони нюхового нерва. Було показано, що інтраназальна інфекція SARS-CoV-1 або MERS-CoV27 призводить до швидкого розповсюдження вірусних частинок в мозок, можливо, через нюхову цибулину шляхом ретроградного аксонального транспорту. Віруси, що розмножуються в носовій порожнині, можуть використовувати прямий зв’язок з нюховою цибулиною для колонізації ЦНС. У цій парадигмі вірус транспортується через аксони нейронів нюхової цибулини з подальшим зараженням специфічного типу нейроглії, сприйнятих клітинами нюхової цибулини. Коли вірус вводили інтраназально в надзвичайно низьких дозах, розповсюдження було лише в ЦНС, посилюючи концепцію внутрішнього нейротропізму коронавірусів. У гризунів абляція нюхової цибулини запобігла поширенню вірусів після назальної інфекції.
Подальша підтримка ролі назально-нюхового шляху походить від клінічних спостережень, згідно з якими аносмія розвивається рано у хворих на SARS-CoV-2. РНК SARS-CoV-2 була присутня протягом 20 і більше днів у зразках секреції ротоглотки та носоглотки 30% людей, що пережили COVID-19, припускаючи, що SARS-CoV-2 може тривалий час затримуватися як на верхніх, так і на нижніх дихальних шляхах.
Вірус також може потрапити в мозок через зараження ендотеліальних клітин, що вистилають судинну систему мозку. Електронно-мікроскопічний аналіз лобової частки виявив вірусні частинки SARS COV-2 в ендотелії з деякими показаннями щодо транзиту вірусу до нейропілю. SARSCov-2 може потрапляти в ЦНС за допомогою периваскулярних просторів лімфатичної системи. Крім того, віруси можуть вторгатися в мозок через інші нерви, такі як трійчастий нерв, який проектує ноцицептивні закінчення в носові порожнини. Подібним чином сенсорні волокна блукаючого нерва, які іннервують дихальні шляхи, можуть представляти інший шлях інвазії.
Подальші докази нейроінфекції SARS-CoV-2, набряків та нейрональної дегенерації були зареєстровані у зразках мозку після смерті, тоді як у випадку секвенування геному енцефаліту підтверджено наявність вірусу в лікворі. Післясмертний аналіз нервової тканини з тканини 54-річного чоловіка, який помер від важкої дихальної недостатності, асоційованої з COVID-19, виявив вірусні частинки SARS-COV-2 в нюховому нерві, в прямій звивині і в стовбурі мозку з ознаками глибокого пошкодження всіх елементів тканини, включаючи гліальні клітини, нейрони, їх аксони та мієлін.
Отже, здається, що SARS-CoV-2, подібно до SARS-CoV-1 та MERS-CoV, інфікує стовбур мозку, в якому розташовані дихальні нейронні ланцюги, і, за аналогією, подібна інфекція може відбуватися і сприяти дихальній недостатності, спостерігається при пневмонії SARS-CoV-2. Дихання залежить від центрального регулятора, розташованого в дорсолатеральному мості, в ядрі одиночного тракту та в вентролатеральному мозку. Цей генератор відповідає за дихальні ритми та контроль рухових нейронів, що іннервують дихальні м’язи. У субпопуляції COVID-19 дихальна недостатність пацієнтів проявляється зниженням частоти дихання з гіпоксією та гіперкапнією. Багато з цих пацієнтів залишаються в комі протягом днів, незважаючи на призупинення седативного лікування та відсутність явних метаболічних змін, що свідчить про вірусний енцефаліт, який часто вирішується без серйозних наслідків. Однак це буває не завжди, і коли ступінь дихальної недостатності надзвичайна, пацієнти вмирають до того, як може стати очевидним пошкодження мозку, спричинене вірусом.
Враховуючи вірусне навантаження на стовбур мозку, подальше зменшення експресії АСЕ2, пов’язане зі смертю нейронів, може призвести до зміни функції барорецепторів, пов’язаного із підвищенням симпатичного тонусу та серйозним загрожуючим життю підвищенням артеріального тиску. Енцефаліт, про який повідомляють як про ускладнення коронавірусної інфекції, незмінно вражає не тільки стовбур головного мозку, але також таламус і білу речовину. Ці аспекти повинні враховуватися клініцистами, які мають справу з пацієнтами з COVID-19, які мають серйозну серцево-судинну та дихальну недостатність. Визнання того, що респіраторні симптоми можуть, принаймні частково, походити від енцефалітичного пошкодження стовбура мозку, може допомогти розробити більш ефективні методи лікування.
Пошкодження стовбура мозку, а також інших структур мозку також може бути результатом системного запалення, яке часто називають синдромом системної запальної реакції або "бурею цитокінів". Одночасно мозок є мішенню для інфекційно-токсичної енцефалопатії, асоційованої із системною токсемією або гіпоксією, які супроводжують гострі інфекційні захворювання. Токсичні енцефалопатії мають масивні неврологічні та психіатричні прояви і навіть набряк мозку, який, однак, розвивається без накопичення маркерів запалення в спинномозковій рідині. Крім того, системна інфекція та високий рівень циркулюючих цитокінів часто пошкоджують мікроциркуляцію, викликаючи набряки та тромбоз; тромбоемболія повідомляється приблизно у 30% пацієнтів. Крім того, цитокіни активують вегетативні нерви та вісь гіпоталамус-гіпофіз-наднирники, які впливають на артеріальний тиск. Всі ці фактори в сукупності обумовлюють ішемічне ураження мозку і пов'язані з виникненням інсультів, які ще більше збільшують смертність у пацієнтів з COVID-19.
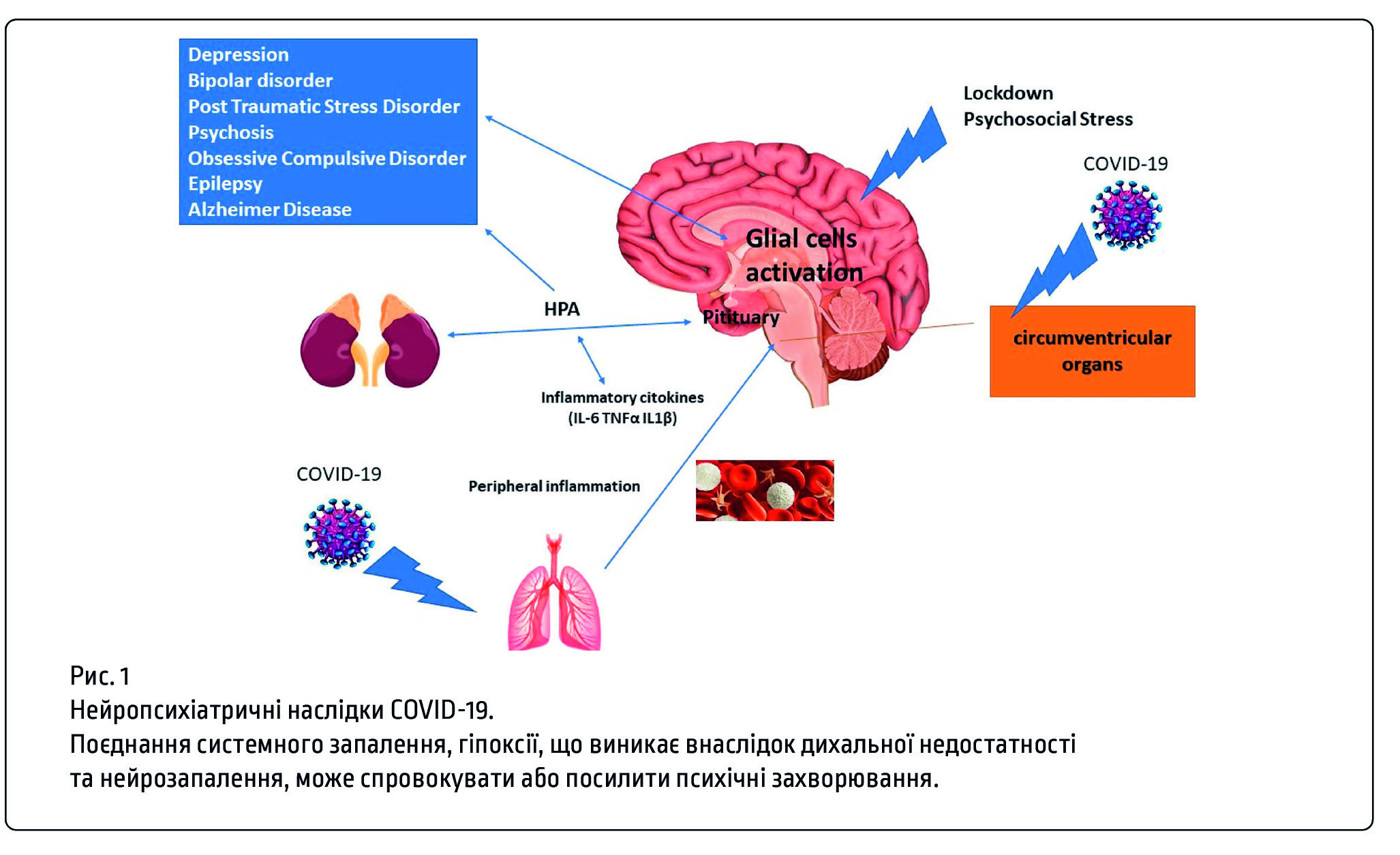
Нейрозапалення при COVID-19
Незважаючи на існування ГЕБ, мозок і спинний мозок взаємодіють з периферичною імунною системою, а отже, кожне системне запалення впливає на ЦНС. У контексті COVID-19 пошкодження ГЕБ, опосередковане масовим збільшенням циркулюючих прозапальних факторів, є дуже ймовірним. Порушений ГЕБ дозволяє запальному шторму охопити ЦНС, що призводить до функціональних пошкоджень. Потрапляючи в мозок, периферичні запальні молекули, а також запальні клітини провокують нейрозапалення, тим самим порушуючи гомеостаз, змінюючи нейронні мережі та індукуючи загибель нейронів.
На початкових фазах системного запалення противірусний імунітет може ефективно притупити вірусне розповсюдження, оскільки реактивність нейроглії та приплив досліджуваних Т-клітин можуть видалити інфекційні елементи, запобігаючи поширенню без подальшого пошкодження тканин. При тяжкому перебігу COVID-19 значне вивільнення хемокінів та інтерлейкінів, пов’язане із системним запаленням та вираженою лімфопенією, забезпечує більш високу та тривалу стійкість вірусного навантаження; отже, недостатній кліренс вірусу разом з реактивним гліозом може продовжувати нейрозапалення. Навіть у легких випадках пневмонія SARS-COV-2 викликає гіпоксію, яка сама по собі може спровокувати або посилити запальну реакцію ЦНС. Церебральна гіпоксія активує ключові фактори запальної транскрипції, включаючи NF-κB та індукуючий фактор гіпоксії, які стимулюють перевиробництво прозапальних месенджерів, ініціюють гліальну реактивність, індукують окисне пошкодження мітохондрій та активують промоторну область численних мікро-РНК, що має вирішальне значення для регуляції експресії генів під час запалення. Надмірна гліальна реактивність внаслідок постійного впливу прозапальних цитокінів також сприяє втраті синапсу та загибелі нейронів.
Вплив інфекції SARS-COV-2 на мозок пов'язаний із надмірним фізичним та психологічним стресом, який стимулює вісь гіпоталамус-гіпофіз-наднирники, тим самим ще більше погіршуючи нейрозапальний статус. Тривалість та частота впливу стресорів впливає на нейрозапалення. У цьому сенсі, хоча реакція на короткі та помірні стресори може бути корисною, повторне або тривале вплив сильних стресорів посилює запалення. Вплив на тривалий стрес посилює запальну реакцію завдяки вивільненню кількох прозапальних факторів, які викликають подальші сигнальні шляхи, включаючи транскрипцію NF-κB. Внесок глюкокортикоїдів, асоційований із реакцією на стрес, у підтримці та стимулюванні нейрозапалення є складним, виходячи за межі ефектів, що виникають внаслідок активації сигналів за їх рецепторами. Експерименти з мікроматрицями продемонстрували, що глюкокортикоїди стимулюють експресію специфічних генних профілів, тоді як одночасна коактивація глюкокортикоїдних рецепторів та NF-κB-залежна транскрипція індукує особливу модель експресії генів, відмінну від тієї, що виникає в результаті окремої активації кожного сигнального шляху.
Нейрозапалення є важливим етіологічним фактором для великої кількості нервово-психічних та нейрокогнітивних захворювань, включаючи нейродегенеративні розлади, депресію, психози, аутизм, зловживання наркотиками, порушення сну та епілепсію. Наразі нервово-психічний тягар цієї пандемії невідомий, але, ймовірно, буде значним. На підставі результатів досліджень останніх епідемій корона-респіраторних вірусів, SARS-COV-1 та MERS-COV, можна припустити, що значний відсоток суб'єктів, які одужують від пневмонії, не відновлюють повністю свій попередній емоційний стан та когнітивні здібності. Дійсно, дослідження нервово-психічних наслідків SARS-COV-1, проведене через 30-50 місяців після зараження, продемонструвало виникнення 40% посттравматичного стресового розладу (ПТСР), 36,4% депресії, 15,6% обсесивного судомного розладу та рівний рівень захворюваності на тривожні розлади. Крім того, метааналіз серед пацієнтів із наслідків SARS-COV-1 із змішаними станами показав нейрокогнітивний дефіцит до 18 місяців після виписки, включаючи легкі когнітивні порушення.
Враховуючи ці докази, тягар тривалого делірію та деменції після SARSCoV-2 може бути помітним, особливо для людей похилого віку, які є більш вразливими до постінфекційних нейрокогнітивних наслідків. Середній вік пацієнтів з важким COVID-19 становить близько 63 років, тоді як пацієнти у віці до п'ятдесяти років становлять лише 26% усіх клінічних випадків. Саме старіння є основним фактором ризику когнітивних патологій та нейродегенерації; важкі системні захворювання, а також стрес провокують або прискорюють когнітивний спад у людей похилого віку. У старечому мозку нейрогенез зменшується, погіршується синаптична пластичність, зменшується обмін речовин і підвищується загальна вразливість мозку до екзогенних уражень. Старіння людського мозку також пов'язане з дегенерацією та атрофією мікроглії та астроцитів, що зменшує гомеостатичну та нейропротекторну підтримку та знову підвищує сприйнятливість мозку до патології. Таким чином, зараження SARSCoV-2 (навіть у помірних клінічних випадках) сприяє когнітивним розладам із виникненням делірію, гострим психозом, загостренням легких когнітивних порушень або прискоренням деменції, пов'язаної з різними нейродегенеративними станами, включаючи хворобу Альцгеймера. Нейрозапалення сприяє патологічному розвитку нейродегенерації і часто розглядається як загальна, навіть об'єднуюча характеристика нейродегенерації, тоді як інфікування мозку та ішемічні ураження самі по собі можуть спровокувати нейродегенеративний процес і спровокувати деменцію.
Загальновизнано, що системне запальне захворювання прискорює когнітивні порушення, що означає, що сама інфекція, як і порушення вродженої імунної системи, відповідає за когнітивні дефіцити. Епідеміологічні спостереження, а також невропатологічний аналіз підтверджують ідею прямої кореляції між системними інфекціями, нейрозапаленням та когнітивними розладами, такими як марення та хвороба Альцгеймера. У цьому контексті когортні дослідження визначили пневмонію як найвидатнішу патологію, відповідальну за прискорення та посилення когнітивного спаду. У той же час щеплення проти бактерій або вірусів зменшують ризик поступової еволюції деменції. Тісна кореляція між пневмонією та делірієм у людей похилого віку є давнім спостереженням, а делірій, який є найпоширенішою подією гострої дисфункції мозку, є частим ускладненням клінічного прогресування COV-19, можливо, через нейровірулентність, важке периферичне запалення , глибокий стрес. Навіть "соціальне дистанціювання" та самотність, які переживають люди похилого віку під час пандемії, сприяють виникненню психотичних епізодів.
COVID-19 та великий депресивний розлад
Системна та тканинна імунна відповідь сприяють патофізіології численних нервово-психічних захворювань шляхом модифікації нейрохімічного середовища, синаптичної передачі та пластичності, синтезу та секреції нейротрофічних факторів, нейрогенезу та мозкового конектома. У цьому контексті великий депресивний розлад є одним з найпоширеніших нервово-психічних розладів, пов'язаних із запальним ураженням головного мозку. Велика кількість доказів пов’язує симптоми депресії з прозапальними факторами та нейрогліальною недостатністю. Це посилання стосується конкретно підтипів депресії, що виникають у людей похилого віку. Старіння суттєво впливає на рівень та активність прозапальних цитокінів у ЦНС. Системна інфекція сама по собі може спричинити серйозну депресію у пацієнтів літнього віку через залежне від віку зниження імунного гомеостазу. Зокрема, підвищений рівень інтерлейкіну-1β у сироватці крові безпосередньо корелює з появою великим депресивним розладом пізнього віку. Подібним чином спостерігається кореляція між запальними факторами та деякими специфічними симптомами, наприклад, високий рівень TNF-α та IL-2 асоціюється з апатією та руховим гальмуванням, тоді як IL-6 асоціюється з ангедонією та суїцидальністю. Рівні цитокінів знижуються, коли пацієнти відновлюють нормальний рівень настрою і навпаки, цитокіни залишаються підвищеними у пацієнтів, стійких до лікування.
Важкі випадки COVID-19 майже незмінно супроводжуються надмірною імунною відповіддю господаря, головним чином характеризується значним підвищенням рівня IL-6 у плазмі крові, що безпосередньо корелює з несприятливим результатом захворювання. У той же час аномально високі концентрації IL-6 були виявлені в мозковій спинномозковій рідині тих, хто намагався здійснити самогубство, у суб'єктів, які страждають або депресією, або шизофренією, у похилих пацієнтів з депресією та у матерів з післяпологовою депресією. Велика кількість доказів продемонструвала, що зміни рівня IL-6 як у плазмі, так і в головному мозку призводять до виникнення депресії, хоча інші фактори, що мають природний або генетичний характер, вносять важливий внесок. У ЦНС ІЛ-6 діє як прозапальний медіатор, який сприяє синтезу та секреції додаткових запальних факторів та білків гострої фази астроцитами та мікроглією.
Таким чином, IL-6, разом з TNF-α та IL-1β, можна розглядати як один з основних регуляторів імунної відповіді мозку, тоді як астроцити та мікроглія є основними реагентами на IL-6, а також відомими виробниками IL-6, стимульований ушкодженнями та патогенно-асоційованими молекулярними структурами (включаючи віруси та їх компоненти), нейромедіаторами та прозапальними месенджерами. Фізіологічні рівні IL-6 у плазмі крові у дорослих коливаються в межах 1–10 пг / мл, тоді як при системному запаленні підвищується до декількох нг / мл; повідомлялося про 114 і навіть більш високі концентрації для COVID 19.
До речі, високий рівень IL-6 був виявлений у плазмі крові, спинномозковій рідині та у передсмертній префронтальній корі суб'єктів із суїцидальними намірами, із нелетальними спробами самогубства або самогубствами. У той же час прямої кореляції не було знайдено між концентрацією IL-6 у плазмі та лікворі у осіб, які намагались здійснити суїцид, а також такої кореляції не виявлено для балів тяжкості депресії. Рівні IL-6 в циркуляції також корелювали із суїцидальною ендофенотиповою поведінкою, такою як розлади властивостей особистості, агресивність та імпульсивність. Це узгоджується з численними висновками, що доводять роль цитокінів у регуляції емоцій та поведінки через взаємодію з конкретними ділянками мозку та різними нейрональними шляхами. Пандемія COVID-19 призвела до значних змін у способі життя та міжособистісних стосунках, засудивши багатьох на тривалу самотність. Ці умови психосоціального стресу можуть також згубно впливати на найбільш тендітних суб'єктів, впливаючи на їх здатність модулювати емоції. Зниження контролю над імпульсивністю та почуттям страху в поєднанні із запальними проблемами мозку може збільшити ризик суїциду.
COVID-19 та біполярний розлад (БР)
Ненормальний баланс між прозапальними (IL-6 і TNF-α) та протизапальними цитокінами в ЦНС і в плазмі неодноразово спостерігався у пацієнтів з БР, що підтверджує думку, що нейроімунна відповідь може бути важливим фактором, що сприяє етіопатогенезу цієї хвороби. У гострих фазах БР або під час маніакального, або депресивного епізоду повідомлялося про активацію запальних каскадів, що багатьма, але не всіма, вважалося характерною ознакою гострої хвороби, а не стійкою ознакою захворювання. Встановлено, що кілька цитокінів, таких як IL-1β, TNF-α, IL-6, інтерферон-γ, збільшують циркуляцію в гострих фазах БР, паралельно знижуючи протизапальні фактори IL-10 і трансформуючи фактор росту β -1, особливо в маніакальній фазі.
Аналіз присутності прозапальних молекул у лікворі у хворих на БР виявив суперечливі результати. Дещо високий рівень ліквору в IL-8, хемоаттрактантний білок 1 моноцитів (MCP-1 / CCL-2) та легкий ланцюг нейрофіламентів були виявлені у суб'єктів БР, хоча ці біомаркери не корелювали з результатом захворювання. Мета-аналіз вмісту цитокінів у лікворі у хворих на БР виявив підвищений рівень IL-1β, IL-8 продемонстрував статистично незначущий підйом і змін щодо IL-6 не виявлено.
Невідповідність між рівнями інтерлейкінів та хемокінів у сироватці крові та у лікворі є іншим спірним питанням. Звичайно, спокусливо припустити, що ця розбіжність втрачена в COVID-19, оскільки перевантаження інтерлейкінів та хемокінів, компрометація ГЕБ та активація резидентів ЦНС та вторгнення в імунні клітини посилює нейрозапалення та сприяє двонаправленому потоку запальних месенджерів через проникний бар’єр . Однак такий сценарій залишається вкрай гіпотетичним, і потрібно набагато більше досліджень та аналізів, щоб виявити можливу зв'язок вірусної інфекції загалом та COVID-19, зокрема, з БР.
COVID-19 та реактивний психоз
Широкий спектр порушення регуляції імунної системи, а також інфекцій (разом із звичайно генетичною вразливістю, відхиленнями в нейромедіаторів, стресом та впливом факторів навколишнього середовища, таких як жорстоке поводження в дитинстві) визнаються потенційними патогенетичними факторами реактивного психозу. Посилене запалення при психозі підтверджено метааналізами, що показують підвищену концентрацію цитокінів та їх рецепторів при хронічній шизофренії, а також у пацієнтів, які не отримували ліків в першому епізоді психозу. Недавнє дослідження, спрямоване на дослідження прозапального профілю цитокінів у пацієнтів з епізодами психозу, показало підвищення регуляції IL-6, TNF-α та IL-1β, що не було виявлено у здорових братів і сестер, припускаючи, що знайома вразливість не бере участь у генерації запалення-асоційованих психотичних реакцій. Намагаючись концептуалізувати ризик виникнення психозу у суб'єктів, інфікованих SARS-COV-2, слід підкреслити, що високий рівень IL-6 корелює зі зменшенням розміру гіпокампа у шизофреніків, принаймні частково, зважаючи на їх когнітивні дефіцити. Більше того, підвищений рівень IL-6 був виявлений у лікворі ліквору хворих на шизофренію. Ще більш інтригуючим є спостереження, що високий рівень IL-6 у підлітків позитивно корелює з виникненням психозу в подальшому житті.
COVID-19 та обсесивно-компульсивний розлад
Зростаюча кількість літератури повідомляє про появу нав'язливих станів у пацієнтів, які нещодавно одужали від вірусного енцефаліту. Вже в 1930-х рр. Більше третини випадків обсесивно-компульсивних розладів (ОКР) були визнані органічними в патогенезі та пов'язані з енцефалітом фон Економо.
Згодом у нейропсихіатричній літературі були розкинуті численні повідомлення про випадки захворювання: від обсесивних синдромів з постенцефалітичним паркінсонізмом до тих, що перебувають після енцефаліту, у яких нецукровий діабет співіснував з ОКР, до шести хворих на ОКР з анамнезом вірусного енцефаліту. Окрім цих ранніх прикладів, нещодавно були виявлені високі рівні імунних комплексів вірусу Борна та вірусних компонентів (білків, РНК) у крові та периферичних одноядерних клітинах хворих на ОКР, що підсилює уявлення про значний зв’язок між вірусною інфекцією та ОКР у схильних суб'єктів. У цьому сценарії, оскільки функціональна нейровізуалізація, продемонстрована ОКР, передбачає зміни в стріато-таламо-кортикальних ланцюгах, було цікавим, що активність цих ланцюгів може впливати на вірусну інфекцію, можливо через перешкоди передачі глутамату.
Поза будь-якими сумнівами, імунна дисфункція відіграє причинну роль у розвитку ОКР у дитинстві, коли раптовий напад нав'язливих симптомів і тиків виникає після стрептококової інфекції, з подальшим продукуванням аутоантитіл проти нейрональних антигенів базальних гангліїв, що надає уявлення про те, що зміни імунної системи можуть бути причетними до патології цих розладів. Численні дослідження показали кореляцію між рівнем прозапальних цитокінів у циркуляції та ОКР. Збільшення концентрації IL-1β, IL-6 та TNF-α у крові у хворих на ОКР було виявлено порівняно із нормальним контролем у парі за статтю, віком та освітою. Ці висновки узгоджуються з результатами досліджень, що вивчають тих, хто не страждає на супутню патології ОКР. Спостереження про збільшення запальних цитокінів у дослідженні, яке усунуло будь-які незрозумілі фактори, такі як тривожна або депресивна супутня патологія або наслідки психотропних препаратів, є більш переконливою підтримкою ідеї про те, що імунологічні відхилення сприяють походженню ОКР. Таким чином, системне запалення, яке є визначною особливістю COVID-19, може спричинити ОКР.
COVID-19 та епілепсія
Література повідомляє про епілепсію та порушення поведінки як тісно пов’язані патології. Дійсно, психічні захворювання частіші у пацієнтів з епілепсією, ніж у загальної популяції, незалежно від часу виникнення судом, які могли виникнути до або після появи психічних розладів, що свідчить про взаємні стосунки та потенційно спільну етіологію. Це інтригуюче співіснування психічних особливостей у хворих на епілепсію не являє собою випадковість чи звичайну супутню патологію, але, швидше за все, воно відображає взаємопов’язані патологічні процеси. Нейрозапалення може натякати на основний механізм, який поділяють епілепсія та психічні розлади, хоча і з чіткою участю нейрональних субстратів. Це робить будь-яке жорстке розділення між епілепсією та деякими психічними розладами менш жорстким, і тому ми включили епілепсію в дискусію щодо значних поведінкових змін та ролі нейрозапалення в його патогенезі.
Зв’язок між епілепсією та нейрозапаленням загальновизнаний. Стійкий нейрозапальний каскад, зумовлений навантаженням цитокінів та пошкодженням ГЕБ, пов’язаний з гліальною реактивністю, синаптичними змінами та утворенням гіперзбудливих мереж з нижчим порогом судом, що сприяє епілептичній активності. Епідеміологічні дані вказують на нейроінфекцію та системні інфекції як на одну з основних причин набутої епілепсії. Наприклад, вірусний енцефаліт збільшує ризик подальших судом. Підвищені концентрації IL-1 були виявлені в плазмі крові та лікворі різного епілептичного фенотипу, що свідчить про ці властивості, що стимулюють припадки цитокінів. Зміни в передачі ГАМК-ергічної трансмісії та зменшення поглинання астроцитарного глутамату можуть спричинити залежне від IL-1 збільшення сприйнятливості до епілепсії. Подібним чином, підвищений рівень IL-6 повідомлявся як у плазмі, так і в лікворі у пацієнтів, які страждають на широкий спектр епілептичних проявів, тоді як це збільшення концентрацій корелювало з тяжкістю судом. Можливість IL-6 сприяти епілептогенезу ще більше підтверджується доказами того, що надмірна експресія IL-6 індукує аномальний іктогенез у мишей в гіпокампі. Поки не повідомляється про зв'язок між епілепсією та COVID-19, однак Американське товариство епілепсії вже припустило, що COVID-19 може збільшити ризик раптової несподіваної смерті при епілепсії (SUDEP). Є деякі повідомлення, які вказують на те, що інфекції, бактеріальні або вірусні можуть збільшити ризик розвитку SUDEP. В даний час немає даних про зв'язок між COVID -19 та SUDEP.
COVID-19 та посттравматичний стресовий розлад
Передбачається, що як тільки травма закінчиться і суб'єкт більше не буде під тиском стресу, починається шлях до стійкого відновлення, оскільки час загоює всі рани. На жаль, це не завжди так, оскільки у сприйнятливих суб'єктів активний стрес стимулює мозкові процеси, в результаті яких травматичні спогади раптово знову виникають і порушують психічне здоров'я. Постійність цих умов породжує посттравматичний стресовий розлад (ПТСР). ПТСР більше не класифікується серед тривожних розладів; це вважається травмою або пов’язаним зі стресовим розладом. Патогенетичний зв’язок між запаленням та ПТСР добре задокументований. Через помітний вплив стресових факторів на імунну систему не дивно, що ПТСР пов’язаний із імунним станом. Підвищена концентрація прозапальних факторів спостерігалася як в системному кровообігу, так і в мозку в контексті ПТСР. Активація нейроглії, індукована важкими або стійкими стресорами, може стимулювати аберрантну секрецію прозапальних сигналів, що потенційно може полегшити появу ПТСР. Дані метааналізів підтверджують значне збільшення прозапальних молекул у осіб з ПТСР, включаючи IL-6, TNF-α та IL-1β.
Рівні IL-10, протизапального інтерлейкіну, також були підвищені, ймовірно, для спроби компенсувати запальні процеси, викликані стресом, додатково підкреслюючи тісний зв'язок між запаленням, стресом та ПТСР. Виникнення ПТСР, як правило, було пов’язане з виникненням слабкого ступеня запалення. Окрім змін у цитокінах, ПТСР також пов'язаний із посиленою експресією NF-κB, цей фактор транскрипції причетний до запального процесу та його підвищена експресія корелює безпосередньо з тяжкістю ПТСР. Більше того, ПТСР, зазвичай, супроводжується депресією, а також тривогою, наркоманією та високою частотою самогубств, оскільки всі ці стани мають спільні запальні механізми у своїх патогенетичних процесах. Однак залишається з’ясувати, чи є взаємини у всіх випадках взаємними і які фактори, поряд із запальними, відіграють причинну роль у визначенні супутніх захворювань. ПТСР може бути можливим результатом для хворих на COVID-19. Це випливає не тільки із тяжкості системного запалення та вірусної інвазії в мозок, але також із тяжкості стресу, спричиненого несподіваною пандемією, яка для високої смертності має шокуюче значення.
Шизофренія та вірусна інфекція
Значна кількість психотичних епізодів після пандемії іспанського грипу підкреслила можливість збільшення частоти шизофренічних розладів у об'єктів, інфікованих SARS-COV-2. У пацієнтів з COVID-19 повідомлялося про високий рівень імунореактивності коронавірусу у пацієнтів із недавніми настаннями психотичних епізодів, а також серйозних нервово-психічних ускладнень, включаючи слухові та зорові галюцинації, а також важких марень. Незважаючи на те, що загальновизнане походження нейророзвитку шизофренії, не можна виключати інших етіологічних факторів, таких як прямий вплив вірусної нейроінфекції або непрямий ефект імунних аберацій, що трапляються у дорослих. Шизофренія також розглядається як нейродегенеративна хвороба у зрілому віці, з усадкою та втратою нейронів, пошкодженням олігодендроцитів, змінами синаптичної зв’язку, імовірно, пов’язаними з когнітивними порушеннями. Хоча відсутні дані, що безпосередньо пов'язують COVID-19 з ризиком шизофренії, часте виникнення психотичних епізодів наголошує на необхідності подальших, більш детальних досліджень.
Висновки
Пандемія SARS-COV-2 створює тривалий виклик, який не тільки вражає серцево-дихальну систему, але і пов'язує системну інфекцію з нервово-психічними захворюваннями. Дослідження попередніх вірусних респіраторних епідемій продемонстрували початок широкого спектра психічних розладів протягом і після інфекції. Пандемія іспанського грипу в 1918–1920 роках підштовхнула до припущення про причинну роль вірусної інфекції в патогенетичному механізмі поведінкових розладів у біполярних та шизофренічних суб’єктів. Карл Меннінгер одним з перших заявив, що його переконали, що деменція praecox (як у ті часи називали шизофренію) є, в більшості випадків, соматопсихозом, "психічними проявами енцефаліту". У той же період Якоб Касанін та Дж. В. Петерсен припустили, що «ретельний огляд деяких ранніх історій атипових випадків шизофренії або афективних розладів може виявити попередній енцефаліт».
В даний час існує мало попередніх досліджень, що розглядають нервово-психічні ускладнення COVID-19, однак, на основі результатів попередніх епідемій різних респіраторних вірусів можна припустити підвищену частоту психічних патологій як небажаних наслідків. Не тільки ГРВІ-COV-2 може проникнути в мозок і спричинити пряме пошкодження нейрональних мереж, досвід потенційно смертельного та невиліковного COVID-19 є причиною сильного дистрессу, який може спричинити довгострокові зміни поведінки або погіршити вже існуючі психічне захворювання. Тут ми окреслили можливі нервово-психічні ускладнення, які можуть виникнути у осіб, інфікованих SARS-COV-2. Пацієнти з COVID-19 можуть мати широкий спектр нервово-психічних симптомів, які виникають внаслідок системного запалення, впливу на ЦНС цитокінів, зараження нервових клітин SARS-COV-2, нейрозапалення, гліальної дисфункції або аберрантних епігенетичних модифікацій генів, пов’язаних зі стресом. Цей огляд мав на меті привернути особливу увагу до психіатричних аспектів COVID-19, оскільки зведення до мінімуму їх актуальності, стверджуючи, що іноді "ненормальна реакція на ненормальну ситуацію - це нормальна поведінка" може бути непростимою помилкою.
Notes
- Holland, H., 1839, Medical Notes and Reflections, Haswell, Barrington, and Haswell, Philadelphia, p. 136.
- Ravenholt, R. T., and Foege, W. H., 1982, 1918 influenza, encephalitis lethargica, parkinsonism, Lancet, v. 2, p. 863.
References
З посиланнями на джерела інформації можна ознайомитись у оригіналі статті: https://www.nature.com/articles/s41398-020-00949-5.pdf
Програми Universum.Clinic :
Програми лікування та супроводу коронавірусної хвороби COVID-19